
Передісторія батарейки починається в далекому 17 столітті, а її дідусем був італійський лікар, анатом, фізіолог і фізик - Луїджі Гальвані. Цей гідна людина є одним з основоположників вчення про електрику і безсумнівним першопрохідцем у вивченні електрофізіології.
Так зване "тварина електрику" Гальвані виявив в ході одного зі своїх експериментів. Він приєднав дві металевих смужки до м'язів жаб'ячої лапки і виявив, що при скороченні м'яза виникає електричний розряд. Втім, спроба пояснити дане явище Гальвані не зовсім вдалася: теоретична основа, яку він підводив, виявилася невірною, але з'ясувалося це значно пізніше. Результати дослідів, отримані Гальвані, півтора століття потому зацікавили його співвітчизника і колегу. Це був Алессандро Вольта.
Ще в молодості зацікавившись вивченням електричних явищ і познайомившись з роботами Б. Франкліна, Вольта встановив в місті Комо перший громовідвід. Крім цього, він відправив паризькому академікові Ж. А. Нолле свій твір, в якому міркував про різні електричні явища. В результаті Вольта зацікавився роботами Гальвані. 
Уважно вивчивши результати дослідів з жабою, Алессандро Вольта зазначив одну деталь, на яку не звернув уваги сам Гальвані: якщо до жабі приєднували дроти з різнорідних металів, м'язові скорочення ставали сильнішими.
Не задовольнившись поясненнями, запропонованими попередником, Вольта зробив надзвичайно сміливе і несподіване припущення: вирішив, що два металу, розділені тілом, в якому багато води, добре проводить електричний струм (жаба, без сумнівів, може бути віднесена до таких тіл), народжують свою власну електричну силу. Щоб не бути голослівним, фізик провів серію додаткових дослідів, які підтвердили його припущення.
У 1800 році, 20 березня, Алессандро Вольта написав президенту Лондонського Королівського Товариства серу Джозефу Бенксу про свій винахід - нове джерело електрики, що отримав назву "вольтів стовп". Сам винахідник не до кінця розумів весь механізм роботи свого дітища і навіть всерйоз вважав, що створив цілком робочу модель вічного двигуна.
До речі, Алессандро Вольта продемонстрував усьому науковому співтовариству чудовий приклад дослідницької скромності: запропонував називати свій винахід "гальванічним елементом", в честь Луїджі Гальвані, чиї досліди навели його на думку.
Як же виглядали перші "батарейки"? Власне, пристрій свого винаходу А. Вольта вельми і вельми докладно описав у своєму листі серові Джозефу Бенксу. Перший же його досвід виглядав наступним чином: Вольта опустив в банку з кислотою мідну і цинкову пластинки, а потім з'єднав їх дротом. Після цього цинкова пластина початку розчинятися, а на мідній стали виділятися бульбашки газу. "Вольтів стовп" - це, можна сказати, стопка з з'єднаних між собою пластинок цинку, міді і сукна, просочених кислотою і складених один на одного в певному порядку. 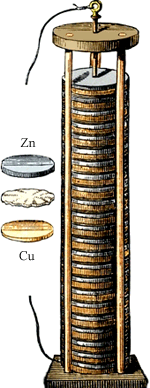
В сучасних "пальчикових" та інших батарейках "начинка" дещо складніше. У корпусі батарейки упаковані хімічні реагенти, при взаємодії яких і виділяється енергія, а також два електроди - анод і катод. Реагенти ці розділені спеціальною прокладкою, яка не дозволяє твердим частинам реагентів перемішуватися, але при цьому пропускає до них рідкий електроліт.
Рідкий електроліт реагує з твердим реагентом, в результаті чого виникає заряд. На реагенте анода він негативний, а на катодному - позитивний. Щоб не сталося нейтралізації зарядів тверді частини реагенту розділені мембраною.
Щоб можна було "зняти" отриманий заряд і передати його на контакти, в анодний реагент вставлений струмознімач, який виглядає дуже просто - тоненький не дуже довгий штирек. Є в батарейці і катодний струмознімач, який розташовується під оболонкою батарейки. Саму оболонку називають зовнішньої гільзою.
Обидва струмознімач стикаються всередині батарейки з анодом і катодом. Схема роботи батарейки в результаті така: хімічна реакція, поділ зарядів на реактивах, перехід зарядів на струмознімач, далі - на електроди і в живиться пристрій.
Існує цілих три класифікації батарейок. Перша - по типорозміру гальванічного елемента. У побуті ми найчастіше користуємося батарейками "пальчиковими" або "мізинчикові", але крім цього є ще середня і велика батарейки циліндричної форми, а також два типи батарейок, форма яких - паралелепіпед: "крона" і просто квадратна. Це - перелік найпоширеніших різновидів форми. 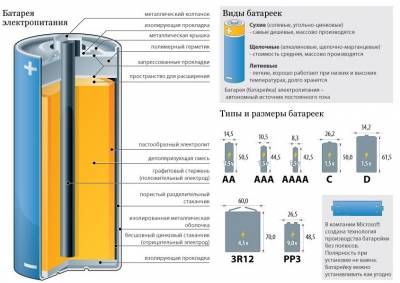
Відрізняються автономні джерела живлення та за типом електроліту. Найдешевші батарейки, як правило, "сольові" - вугільно-цинкові, цей електроліт сухий. Ще один варіант сухого електроліту - хлорид цинку. Такі батарейки теж досить дешеві і широко поширені.
Наступний варіант електроліту - лужний. На цих батарейках написано Alkaline, а всередині - лужно-марганцеві, марганцево-цинковий електроліт. Їх основний недолік - високий вміст ртуті.
Батарейки з ртутним електролітом на сьогоднішній день практично не виробляються. Срібний електроліт показує хороші експлуатаційні властивості, однак виробництво таких батарей коштує дуже великих грошей.
Повітряно-цинковий електроліт - найбезпечніший для людини і навколишнього середовища. Коштують вони недорого, зберігаються довго. Ось тільки товщина батарейки в 1,5 рази більше звичайної лужної / срібною. Крім того, щоб виключити саморозряд під час її зберігання, потрібно заклеювати батарейку. Літієві батареї - досить дороги, проте їх експлуатаційні характеристики значно перевищують показники інших батарейок.
Ще один спосіб поділити батарейки на групи - визначити тип хімічної реакції, який в них відбувається. Первинна реакція відбувається в гальванічних елементах - в самих звичайних батарейках. Вторинної зарядці вони не піддаються, на відміну від акумуляторних батарей, в яких відбувається вторинна хім.реакція.
Батарейки небажано застосовувати при крайніх температурах - сильно охолоджувати або нагрівати. Це може привести до дуже неприємних наслідків. Якщо вам довелося використовувати батарейки в холоді, наприклад, взимку на вулиці, рекомендується не менше півгодини витримати їх в кімнатній температурі.
Трапляється, що батарейки, особливо лужні, течуть. Таке відбувається коли порушується герметичність корпусу батарейки. Використовувати ці батарейки ні в якому разі не можна - це може привести до пошкоджень електроприладів.
Що стосується утилізації відпрацьованих батарейок або акумуляторів, то цим повинні займатися спеціальні організації або підприємства. У великих містах можна знайти спеціально організовані приймальні пункти, куди можна здати використані батарейки для їх подальшої утилізації. Правда, не в кожному місті такий пункт прийому організований. Питання, що робити в цьому випадку залишається відкритим.
- А. Вольта. "Про електриці, порушуються простим зіткненням різних проводять речовин".
- Радовський М.І. "Гальвані і Вольта".
- Спаський Б.І. "Історія фізики".
- Вільна електронна енциклопедія Вікіпедія, розділ "Хімічне джерело струму".
- Вільна електронна енциклопедія Вікіпедія, розділ "Типорозміри гальванічних елементів".

